
Content
- etapes
- Mètode 1 Utilitzant un mesurador de pH
- Mètode 2 Utilitzeu paper de gira-sol
- Mètode 3 Comprensió del pH
És important analitzar el pH de l’aigua (és a dir, el seu nivell d’acidesa o alcalinitat). L’aigua és consumida per les plantes i animals de què depenem i la consumim directament cada dia. El pH de l’aigua pot proporcionar pistes de contaminació potencial. Per tant, l’anàlisi del pH de l’aigua és una mesura important de salut pública.
etapes
Mètode 1 Utilitzant un mesurador de pH
-

Calibreu la sonda i el mesurador segons les instruccions del fabricant. Per calibrar-lo, potser haureu de provar el mesurador amb una substància de pH coneguda. Podeu ajustar-lo en funció d’aquestes mesures. Si voleu analitzar l’aigua fora d’un laboratori, heu de realitzar la calibració abans de danyar l’aparell al camp.- Esbandiu la sonda amb aigua neta abans d’utilitzar-la. Assequeu-lo amb un drap net.
-

Recolliu una mostra d’aigua en un recipient net.- La mostra d’aigua ha de ser prou profunda perquè es tapi la punta de l’elèctrode.
- Deixeu reposar la mostra una estona perquè la temperatura tingui temps d’estabilització.
- Mesureu la temperatura de la mostra amb un termòmetre.
-

Configureu el mesurador segons la temperatura de la mostra. La sensibilitat de la sonda està afectada per la temperatura de l’aigua i la mesura indicada pot no ser bona si no introduïu les dades de temperatura. -

Col·loca la sonda a la mostra. Espereu que el comptador s’equilibri. S'aconsegueix quan la mesura es manté estable. -

Llegiu la mesura del pH de la mostra. El pHmetre us ha de proporcionar una mesura en una escala de 0-14. Si l’aigua és pura, la mesura hauria de ser prop de 7. Anoteu els vostres registres.
Mètode 2 Utilitzeu paper de gira-sol
-

Obteniu informació sobre la diferència entre paper pH i paper de gira-sol. Per obtenir una mesura correcta d’una solució, podeu utilitzar paper pH. No s’ha de confondre amb el paper de gira-sol actual. Totes dues es poden utilitzar per analitzar àcids i bases, però són radicalment diferents.- Les bandes de pH contenen una sèrie de columnes indicadores que canvien de color després d’haver estat exposades a una solució. La intensitat dels àcids i bases de cada columna difereix. Un cop canvien, es poden comparar els colors amb els exemples que es proporcionen al kit.
- El paper de gira-sol es compon de tires de paper que contenen un àcid o una base (alcalina). Són vermells la majoria de les vegades (si contenen un àcid que reacciona amb les bases) o blaus (si contenen una base que reacciona amb els àcids). Les bandes vermelles es tornen blaves si la substància és alcalina, les bandes blaves es tornen vermelles si estan en contacte amb un àcid.Els papers de girasol es poden utilitzar per a mesuraments ràpids i fàcils, però els més barats no necessàriament permeten mesurar amb precisió el pH d’una solució.
-

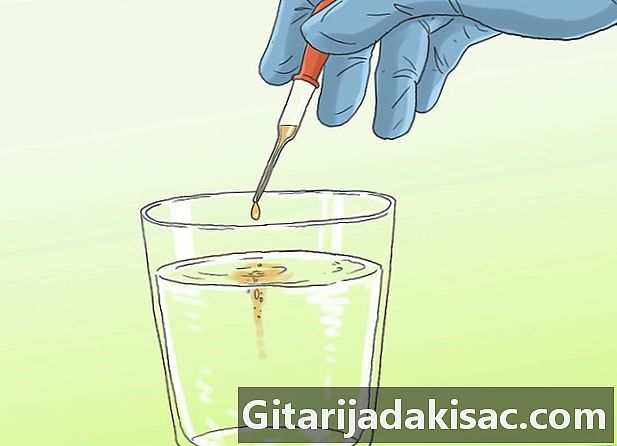
Recolliu una mostra d’aigua en un recipient net. La mostra ha de ser prou profunda perquè es cobreixi la cinta. -

Introduïu una tira de paper a la mostra. Haurien de ser suficients uns segons d’exposició. Les diferents columnes del paper començaran a canviar de color en uns moments. -

Compareu el final de la cinta d’anàlisi amb el gràfic de colors proporcionat amb el paper. Els colors del gràfic han de coincidir amb els de la vostra banda. Cada color ha d’associar-se a una mesura del pH.
Mètode 3 Comprensió del pH
-
Descobriu com es defineixen els àcids i les bases. La laciïtat i l’alcalinitat (el terme utilitzat per descriure les bases) són definits pels ions d’hidrogen que perden o accepten. Un àcid és una substància que perd (o segons alguns, dóna) ions d'hidrogen. -
Comprendre l'escala de pH. El número de pH s’utilitza per avaluar el nivell d’acidesa o alcalinitat de substàncies hidrosolubles. L’aigua conté normalment un nombre equivalent d’ions hidròxid (OH-) i hidroni (H30 +). Quan s’afegeix una substància àcida o alcalina a l’aigua, modifica la proporció d’ions hidròxid i hidroni.- Aquest nombre es troba normalment en una escala de 0 a 14 (tot i que algunes substàncies poden superar aquest rang). Les substàncies neutres tenen un pH proper a 7, substàncies àcides per sota de 7 i substàncies alcalines per sobre de 7.
- L’escala de pH és logarítmica, cosa que significa que una diferència d’una unitat és en realitat una diferència de 10 vegades més gran en acidesa o alcalinitat. Per exemple, una substància amb un pH de 2 és en realitat 10 vegades més àcida que una substància el pH és 3 i 100 vegades més àcid que una substància amb un pH de 4. L’escala funciona de la mateixa manera per a les substàncies alcalines, una unitat de mesura corresponent a una diferència de deu.
-

Saber per què volem mesurar el pH de l’aigua. L’aigua pura ha de tenir un pH de 7, però l’aigua de l’aixeta sol tenir un pH entre 5,5 i 6. L’aigua altament àcida (amb pH baix) és més probable que es dissolgui productes tòxics. Aquests poden contaminar l’aigua i tornar-la inadequada per al consum humà.- Generalment es prefereix mesurar el pH in situ. Si recolliu una mostra d'aigua per a l'estudi en un laboratori, el diòxid de carboni que es troba en l'aigua es pot dissoldre a l'aigua. Aquest diòxid de carboni dissolt reacciona amb els ions presents a l’aigua i augmenta l’acidesa de les solucions bàsiques o neutres. Per evitar la contaminació amb diòxid de carboni, heu de mesurar l’aigua menys de dues hores després de ser recollida.